- 前言前言前言

Vi-CELL BLU细胞计数和活率分析仪最少仅需170uL样品体积即可得到细胞密度和活率结果。为了准确分析不同细胞,Vi-CELL BLU提供了创建和优化自定义Cell Type设置的功能。本文我们拿容易团聚的HEK293细胞给大家介绍下Cell Type的设置是如何影响样品的处理和图像分析。
在分析团聚细胞时,Cell Type设置中首先会使用到的参数是Decluster degree,我们可以设置为None,Low,Medium或High,并且使用更靠后的值会增加软件对团聚细胞的识别能力。
当出现过多的团聚,我们还需要考虑增加对样品的Aspiration和Mixing Cycles次数。在每次Aspiration过程中,细胞样品会在样品管和注射器之间来回吹打混悬。对于那些很难混悬分散或倾向于粘到样品杯壁上的细胞样品,建议使用这种方法。在Mixing Cycle过程中,台盼蓝和细胞样品一起在样品管和注射器之间来回混匀。增加Mixing Cycles次数会让台盼蓝混匀地更好。Vi-CELL BLU细胞计数和活率分析仪的设计降低了剪切力对细胞的伤害。另外,低剪切力可以提高结果的重现性。但增加Aspiration或Mixing Cycles会提高额外剪切力,从而对比较脆弱的细胞产生潜在的危害。但是,对于团聚细胞系,这些额外的剪切力则可以用于破坏细胞的团聚。
Decluster degree和Aspiration/Mixing Cycles之间重要的区别在于它们是在哪个时刻影响的分析结果。Decluster degree只对测试结束后保存在软件上的细胞照片根据不同设置的Decuster degree重新进行分析。而Aspiration和Mixing Cycles是在拍照前对细胞样品就产生了影响,测试结束后无法再修改Aspiration和Mixing Cycles数值,得到再分析的结果。
因此,优化Cell Type对于得到好的结果很重要,本文中对于团聚细胞分析,如何调整Cell Type提供了一些指导。
团聚的细胞悬液也是细胞培养条件欠佳的指标,包括但不限于过度消化、环境应激、过度生长和污染。细胞团聚限制了细胞对资源和可用增殖空间的获取。这将阻碍细胞生长,降低通量,并影响下游分析结果,譬如像流式细胞仪分析方法需要单细胞溶液。此外,ISO 20391-1(4)中声明,为了获得最佳计数结果(与所使用的分析方法无关),需要单细胞悬浮液,并且需要正确的样品制备流程。Vi-CELL BLU 细胞计数和活率分析仪用红色框标记(非常)大的细胞团。由于对大细胞团进行计数容易出错,因此这些大细胞团不会进行去团聚处理,并会自动从计数中排除。这些大细胞团的数量可以在结果文件的“Cluster Count”中找到,这是培养物中细胞团聚的良好指标。如果观察到细胞团较多时,建议进一步优化培养条件或进行样品处理。
方法
这些实验中使用的是FreeStyle 293-F 细胞(Thermo Fisher,Cat.编号:R79007)。将 HEK 悬浮细胞在含有FreeStyle 293(30 mL)表达培养基的 50 mL Falcon 管中培养,每 3-4 天传代培养一次,接种细胞密度为 0.2x106 个细胞/mL。它们在 37°C、250 rpm 和 5% CO2 浓度下孵育。
使用培养 4 天的细胞样品进行初始测量,在Normal模式下使用Mammalian Cell Type重复测量 5 次。然后结果被导出(每 10 张图像照片保存一张)并离线重新分析。为了重新分析,基于默认的Mammalian Cell Type创建了另外两个Cell Type,但将去团聚度设置为Low和High。为了研究不同去团聚度设置的有效性,比较了这三种Cell Type总细胞密度和活细胞密度以及活率的结果。
之后,开始用 HEK 293-F 细胞进行新鲜培养,并在第 0、1、2、3 和 6 天取样。然后,测试了其他采样参数,因为所有日期的样品都用默认的Mammalian Cell Type,以及将Aspiration和Mixing Cycles增加到10次的Cell Type。在所有采样日,将细胞培养液用 5 mL 移液器混合 2 次,然后将 5 mL 细胞培养液转移到 15 mL Facon管中。接着,用 1000 μL 移液器将样品再混合 3 次,再将 3 x 500 μL 细胞样品转移到 Vi-CELL XR 细胞计数和活率分析仪样品管中,以及将 6 x 200 μL 细胞样品转移到 Vi-CELL BLU 96 孔板中。Vi-CELL XR 细胞计数和活率分析仪上的样品,使用图 1 所示的Cell Type分析;在Vi-CELL BLU细胞计数和活率分析仪上,两种Cell Type交替进行。然后,将 2 x 10 μL 细胞样品与台盼蓝 1:1 混合并转移到一次性血球计数板中手动计数。

图1:Vi-CELL XR上的分析设置,选择的设置类似于Vi-CELL BLU上的设置
然后,在Vi-CELL BLU细胞计数和活率分析仪上运行的样品以High Decluster degree重新分析,在 Vi-CELL BLU 细胞计数和活率分析仪上共生成4种不同的细胞计数结果,以与 Vi-CELL XR细胞计数和活率分析仪的结果和手动计数结果进行比较。
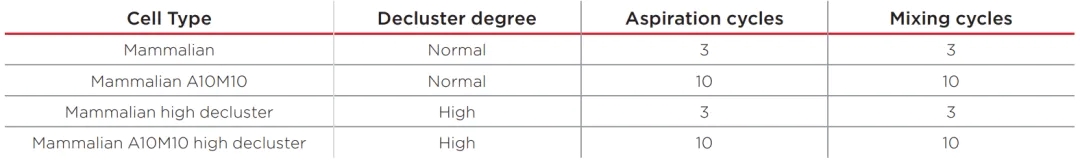
表1. Vi-CELL BLU分析HEK 293-F的Cell Type,Mammalian Cell Type作为其他3个Cell Types的模板。
结果
在三个Decluster degree下(Low,Normal和High)得到的平均总细胞密度和活细胞密度(分别为 TCD 和 VCD)和活率进行了比较(图2)。更高的去团聚度使得TCD 和 VCD 值均明显增加(R2 > 0.98)。然而,使用较低或较高的Decluster degree时,细胞活率却并不显著增加或减少。
图2:Vi-CELL BLU使用不同Decluster degree设置分析HEK 293-F的结果。平均总细胞和活细胞密度显示在左轴上,平均活率显示在右轴上。误差线表示标准差。
表 2 中的图像显示了Decluster degree如何影响样品分析,从而影响细胞浓度结果。所选图像是图2中其中一个测量样品的图像(部分),并且很好地表示了细胞样品的状态。如前所述,HEK 293 F细胞倾向于形成团聚体,而这些团聚体中的细胞可能难以计数准确。当 Decluster degree 设置为 low 时,某些团聚将不再被解聚,并且标有蓝色圆圈,表示Vi-CELL软件错误地将它们识别为单个颗粒,因为其尺寸较大,根据所选Cell Type参数未归为一个细胞。通过更高的去团聚度,可以分析更多这些团聚细胞,从而产生单个团聚标记为Normal Decluster degree,所有团聚细胞均在High declustering下进行分析。更高的Decluster degree设置会导致识别出额外的细胞,可能导致人为地提高细胞密度,因为单个细胞可能(几乎)分裂成两个或多个颗粒。这些颗粒是被忽略还是算作活细胞或死细胞取决于其他Cell Type参数,例如大小、圆度和亮度。因此,优化Cell Type设置对于获得准确的结果很重要。
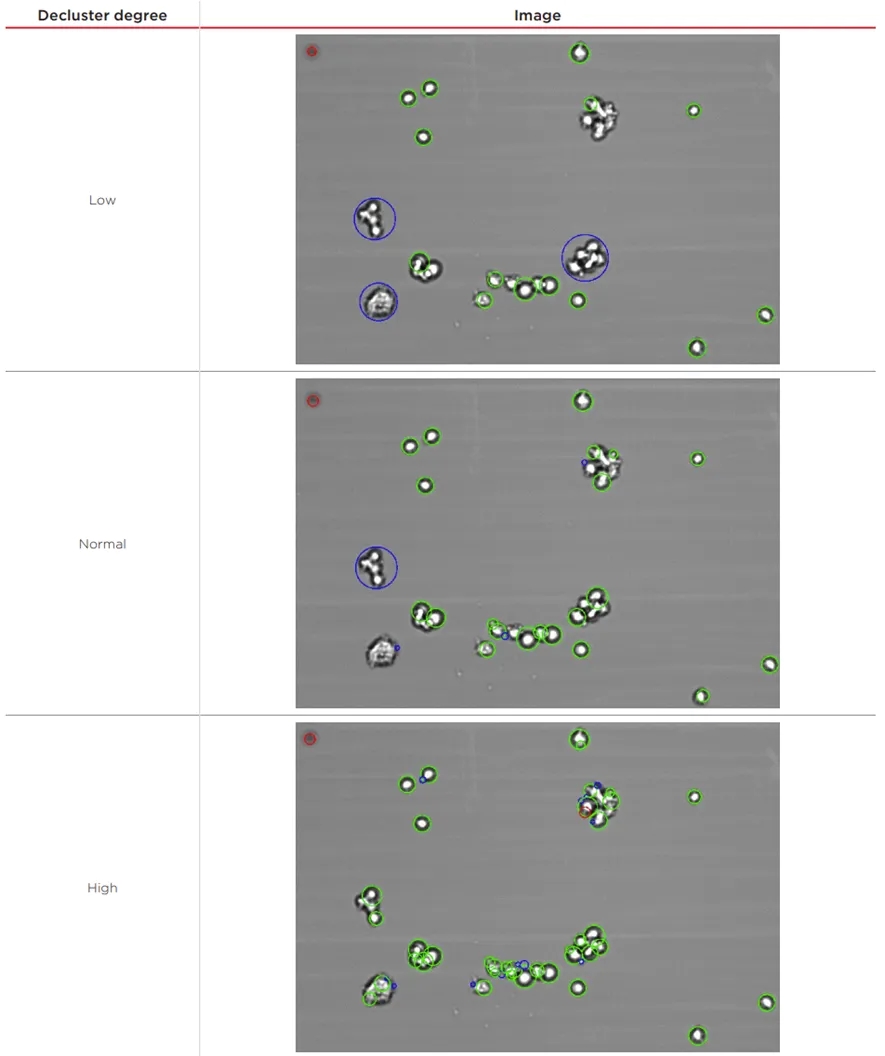
表2. 不同Decluster degree设置的分析结果,随着Declustering增加,更多的细胞团聚被分析,细胞团聚体中更多的细胞被识别。
请注意,Cluster count不受Decluster degree的影响。对于“Low”和“High”设置,每次测量平均计数 1.6 个Clusters。Cluster count指示在样本中发现了多少个过大的细胞团聚体。这些Cluster用红色框标记,并且无论Decluster degree如何,都完全排除在分析之外。因此,高的Cluster count是大细胞团聚体的良好指示,需要在培养处理或样品制备方面进行额外优化,以获得准确的细胞计数结果。
最终,在优化Cell Type设置时,Vi-CELL BLU 软件还提供了增加Aspiration和Mixing cycles的可能性。增加Aspiration和Mixing的影响评估,是使用默认的Mammalian Cell Type,将其中的Aspiration和Mixing cycles都设为10,每天对 HEK 293-F 细胞样品进行采样,并一式三份测定细胞密度。之后,使用表1所述的High Decluster degree重新分析所有测量值。将结果与使用Vi-CELL XR细胞计数和活率分析仪及手动计数获得的值进行比较(图3)。
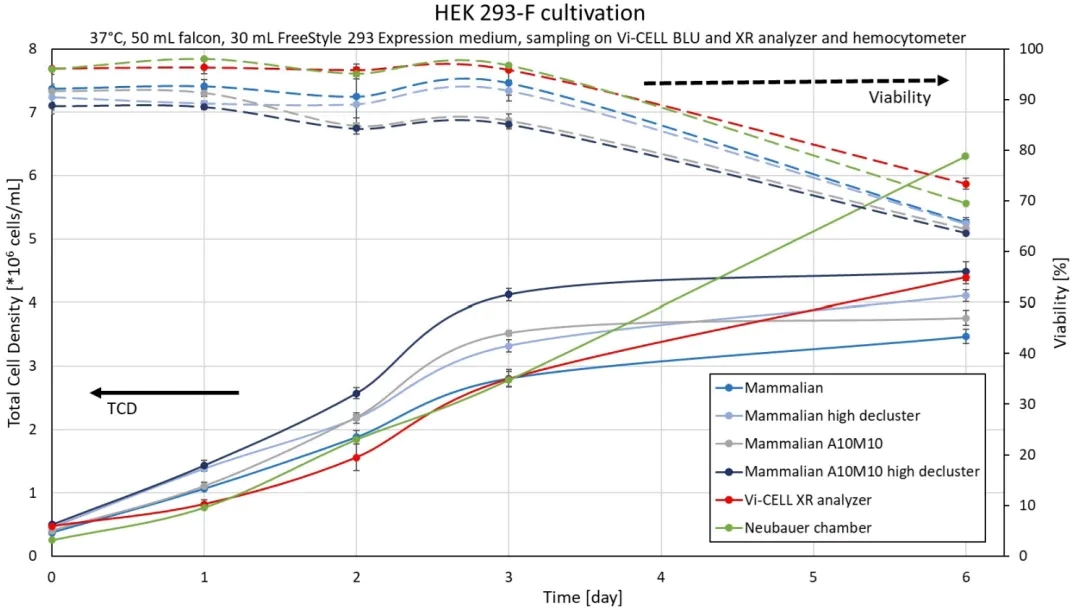
图3: Vi-CELL BLU用4种不同Cell Types检测的总细胞密度和活率(蓝-灰色),Vi-CELL XR(红色)和手动细胞计数(绿色)。误差线表示标准差。
图 3 显示了 Vi-CELL XR细胞计数和活率分析仪、血球计数板、Vi-CELL BLU 细胞计数和活率分析仪(使用默认Mammalian Cell Type)测试6天得到的细胞密度和活率具有可比性。此外,Mixing增加和/或High declustering的Cell Type会导致更高的细胞密度。在第3天,测量的平均 TCD 介于 2.81 – 4.12 百万个细胞/mL 之间,分别使用默认的 Mammalian 和 Mammalian A10M10 High decluster。因此,与默认设置相比,更改两个参数后结果增加了 47%。
然而,在第6天存活率下降到~70%,而且手动计数的TCD明显比自动细胞计数仪的TCD更高。表 3 中的图像(通过显微镜显示 Neubauer 分析室)为这种偏差提供了清晰地解释,因为与第 3 天相比,第 6 天的细胞样品中显示有更多的细胞聚集体。这些细胞聚集体很难计数,在分析过程中将完全忽略大的团聚细胞。

表3: 第3和第6天HEK 293-F细胞计数显微镜下的照片。第6天可以看到更多的细胞团聚体,细胞活率降低。
专注于培养的前 3 天(图 4)可以进一步研究不同的Cell Type设置如何影响计数结果。第 3 天血球计数板图像(表 3)显示,到目前为止,细胞主要以小聚集体或单细胞形式生长。仔细观察Cluster count可以发现,Clusters的平均数量从第 1 天的 0.7 个增加到第 2 天的 3.7 个和第 3 天的 8.7 个。同时,更高的Mixing和Aspiration cycles的效果似乎有所增加,第 1 天的 TCD 增加了 4%,而第 2 天和第 3 天分别增加了 17% 和 25%。在Mammalian A10M10 High decluster设置下的结果一直是最高浓度。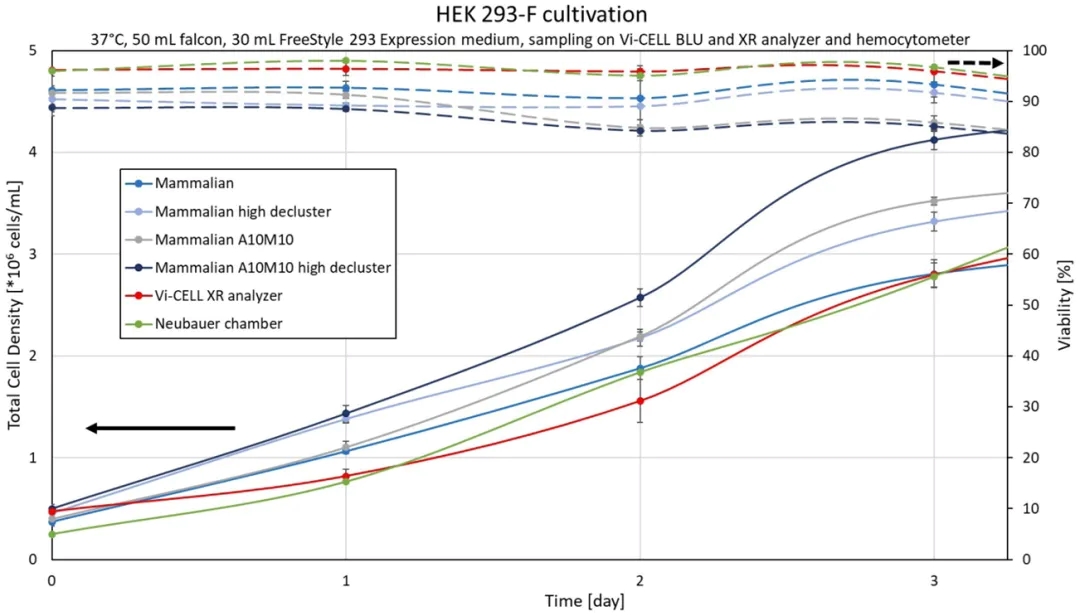
图4: HEK培养的前3天。在 Vi-CELL BLU 上以蓝灰色以及 Vi-CELL XR(红色)和手动计数(绿色)测定四种不同的细胞密度和活率。误差线表示标准差。
总之,每日采样结果进一步证明了正确Cell Type设置的重要性。仅改变三个参数就导致 TCD 增加 47%。测量团聚的HEK细胞时,调整Decluster degree和Mixing/Aspiration cycles可以得到更高的TCD。然而,第6天的数据(图3)表明,应避免过度团聚的细胞样品,因为与手动计数相比,所有Cell Type的结果都明显较低。
讨论
本文讨论了使用 Vi-CELL BLU 细胞计数和活率分析仪优化细胞计数结果的几种选择。除了优化一般的培养处理 - 这将改善细胞健康、通量和产率 – 可以通过调整样品处理和分析来改进。通过演示使用不同Cell Type设置的影响,可以清楚地看出针对所用细胞系和应用优化这些设置对于获得好的分析结果至关重要。
在处理倾向于形成聚集体的细胞系时,对Decluster degree、Aspiration cycles和Mixing cycles的拟议更改是优化计数性能的良好起点。但是,当可能需要进一步优化时,请随时向贝克曼库尔特生命科学的相关技术人员寻求支持。
● 参考资料:
1. Cell Culture Problems: Cell Clumping – Causes, How to Unclump Cells & How to Avoid Cell Clumping. akadeum.com. [Online] Akadeum Life Sciences, February 2021. [Cited: 25 July 2023.] https://www.akadeum.com/blog/cell-clumping/.
2. Cell Clumping Troubleshooting. Sigma Aldrich. [Online] Merck KGaA. [Cited: 25 July 2023.] https://www.sigmaaldrich.com/US/en/technical-documents/technical-article/cell-culture-and-cellculture-analysis/mammalian-cell-culture/cell-clumping-troubleshooting.
3. Biomass and Aggregation Analysis of Human Embryonic Kidney 293 Suspension Cell Cultures by Particle Size Measurement. Yung-Shyeng Tsao, Russell G. G. Condon, Eugene J. Schaefer, David A. Lindsay, and Zhong Liu. s.l. : Biotechnology progress, 2000, Bd. 16(5). 809-814.
4. ISO 20391-1. Biotechnology — Cell counting — Part 1: General guidance on cell counting methods. s.l. : ISO/TC 276, Biotechnology, 2018-01. First edition. ISO 20391-1:2018(E). 5. Cluster Count Analysis and Sample Preparation Considerations for the Vi-CELL BLU Cell Viability Analyzer. Wu, Andrew. s.l. : Beckman Coulter Life Sciences, 2023. 2023-GBL-EN-101754.
5. Cluster Count Analysis and Sample Preparation Considerations for the Vi-CELL BLU Cell Viability Analyzer. Wu, Andrew. s.l. : Beckman Coulter Life Sciences, 2023. 2023-GBL-EN-101754.
