自噬-溶酶体途径是真核生物细胞内用来抵抗病原菌,清除变性蛋白和异常细胞器的主要机制之一。自噬-溶酶体途径的异常和包括帕金森症、阿兹海默症在内的多种神经退行性疾病以及癌症密切相关。TFEB 是非常重要的转录因子,调控自噬相关基因的表达,在自噬通路中发挥重要作用和功能,但具体作用机制目前尚不清楚。
2019年1月21日中国科学院生物物理研究所在《Autophagy》(IF:11.059)上在线发表了题为“YWHA/14-3-3 proteins recognize phosphorylated TFEB by a noncanonical mode for controlling TFEB cytoplasmic localization” 的文章揭示了YWHA/14-3-3与转录因子TFEB结合并调控TFEB亚细胞定位和转录活性的机制。

该研究中作者通过结构生物学与生化手段,解析了YWHA/14-3-3与TFEB-p-S211复合物的结构,利用结构信息发现YWHA/14-3-3与TFEB-p-S211以一种新的非典型模式结合。
通过进一步对蛋白与小肽相互作用界面上的关键氨基酸进行突变并结合细胞定位实验,提出了潜在的YWHA/14-3-3 蛋白调节 TFEB 的入核机制。这对于以 TFEB为靶点的新的治疗方案的研究有指导作用。
作者首先对YWHA/14-3-3和TFEB两个蛋白进行二级结构预测以及结构域分析,结合已有的报道分析出磷酸化的TFEB中S142和S211两个位点与调控TFEB的亚细胞定位有关(图1. A,B)。
由吉凯基因构建TFEB及其关键位点突变体的质粒,通过免疫共沉淀实验(图1. C)分别验证野生型TFEB 以及突变体与YWHA/14-3-3 蛋白两种亚型的相互作用关系。通过ITC实验(图1. D)比较它们之间的结合力大小,进一步证明了只有磷酸化的TFEB中S211位点与YWHA/14-3-3 蛋白存在相互作用。

图1. 磷酸化的TFEB中S211位点与YWHA/14-3-3 蛋白存在相互作用
作者分别解析了YWHA/14-3-3蛋白的两种亚型YWHAB和YWHAG分别与TFEB-p-S211形成复合物的结构。在复合物结构中整体结构为二聚体,在每个单体均由9个反向平行的 α 螺旋(αA-αI)构成。αA-αD形成马蹄铁状结构域,并且二聚体的两个亚基是双面对称的(图2. A-C)。
二聚体的每个亚基中,αC,αE,αG 和 αI 构成一个两亲性的底物结合沟槽(活性中心),并特异性结合TFEB-p-S211 磷酸化小肽(图2. D,E)。
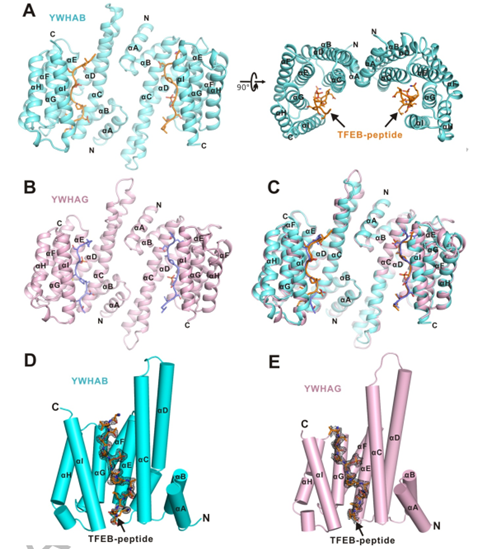
图2. YWHA/14-3-3蛋白的两种亚型分别与TFEB-p-S211复合物的整体结构图
作者选取了YWHAB 和 TFEB-p-S211复合物的结构进行后续详细的结构分析。YWHAB 和 TFEB-p-S211的结合主要是通过疏水作用力,静电相互作用以及氢键相互作用。
小肽TFEB-p-S211顶部主要是通过S209侧链以及E182与YWHAB形成氢键相互作用,中部通过R129、R58、Y130、K51以静电荷和氢键相互作用协同帮助YWHAB 与 TFEB-p-S211结合,小肽TFEB-p-S211下部作用界面主要以疏水相互作用构成(图3)。
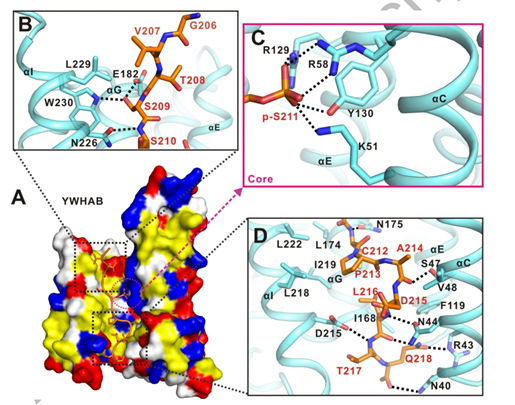
图3. LECT2与Tie1直接结合
作者对现有的YWHA/14-3-3三种结合基序进行了分析,已报道的YWHA/14-3-3与 mode I/II 磷酸化小肽复合物结构中,-3 或-4 位的精氨酸在顶部结合区域,与YWHA/14-3-3的底物结合凹槽形成静电相互作用。
mode III结合模式是识别羧基端末尾的磷酸化小肽,N 端的精氨酸消失。而文中提及的TFEB-p-S211结合YWHA/14-3-3 是一种新型非经典的结合方式,缺少 N 端的静电作用,但是多出了 C 端的疏水作用和氢键相互作用。因此,作者把它定义为 mode IV(图4)。
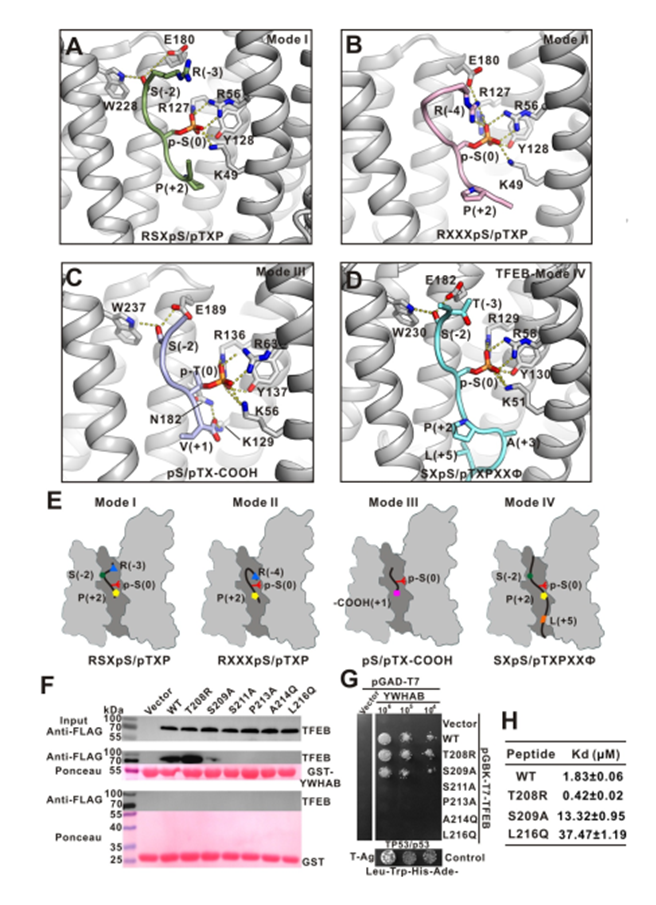
图4. LECT2中断Tie1 / Tie2异二聚化,Tie1对LECT2的功能行使发挥重要作用
作者通过对TFEB 全长蛋白进行了定点突变以破坏小肽与蛋白的相互作用界面,看是否能对TFEB 的亚细胞定位造成影响(图5. A、B)。
实验表明静息态的细胞在营养充足的条件下,被mTORC1磷酸化的TFEB通过与衔接蛋白YWHA/14-3-3的相互作用被滞留在细胞质中;而在细胞处于饥饿或者溶酶体功能障碍的状态下,钙调磷酸酶(calcineurin)使TFEB去磷酸化,导致TFEB与YWHA/14-3-3分离并进入细胞核激活TFEB靶基因的转录。
因此YWHA/14-3-3是TFEB在细胞质和细胞核之间位置转换的关键调控因子。基于上述实验结果作者提出了潜在的 YWHA/14-3-3 蛋白调节 TFEB 入核机制模型图(图5. C)。TFEB 的核定位序列与YWHA/14-3-3 结合位点 S211空间距离很近,当 TFEB 和 YWHA/14-3-3蛋白结合可能会诱导pS211 和 NLS 之间的区域发生构象变化,使 NLS 序列被遮挡从而导致不能细胞核锚定。
反之经过饥饿处理后,S211位点被去磷酸化,TFEB 和 YWHA/14-3-3蛋白分离,NLS 序列暴露出来,从而介导细胞核锚定和入核。
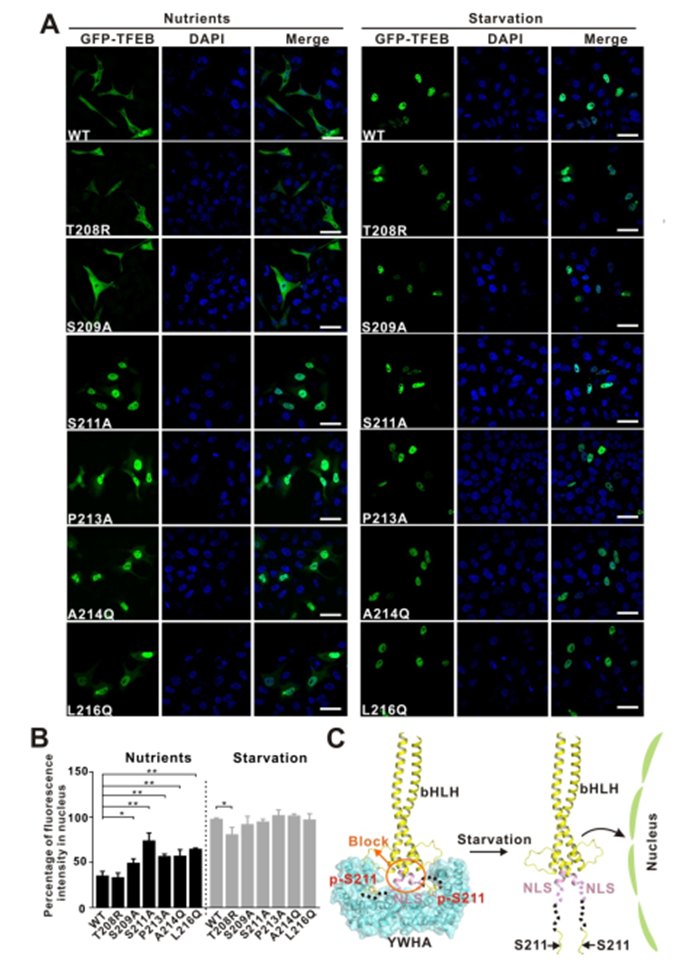
图5. YWHA/14-3-3蛋白和 TFEB 之间的作用关系调控 TFEB 亚细胞定位
总结
1、 解析了YWHA/14-3-3蛋白的两种亚型分别与TFEB-p-S211复合物的结构;
2、 提出YWHA/14-3-3蛋白通过非典型模式识别TFEB-p-S211;
3、 提出可能的 YWHA/14-3-3 蛋白调节 TFEB 入核机制
吉凯助力
该研究的Co-IP实验部分,TFEB及其突变体的质粒均由吉凯基因设计构建,所用载体为pcDNA3.1-3×FLAG。其转染HeLa细胞后有效的过表达TFEB及其突变体蛋白(图6),进而帮助证明了只有S211位点突变后会影响YWHA/14-3-3和TFEB的相互作用。

图6. Western blot检测TFEB及其突变体过表达效果
吉凯基因,年产上万次慢病毒、腺病毒、腺相关病毒;
建有国内大型的慢病毒文库,包含几乎覆盖人类所有基因的,近 15 万个独立克隆;
国内集产品采购和资讯分享的一体化综合服务平台,为科研工作者提供一键式的采购服务,产品周期短至 5 个工作日起;
17 年品质保证、助力客户发表10000+ 篇 SCI,多项科研成果发表于Nature Medicine、Nature Immunology、Gastroenterology、Cell Metabolism、Nature Neuroscience等顶级期刊上
