质谱流式技术实现在单细胞水平检测几十个通道的同时检测,可以系统全面的分析病理状态下各类免疫细胞在表型和功能上的变化,从中发现一些新的免疫细胞亚群、揭示新的免疫机制。近年来,越来越多的实验室将质谱流式用于HIV的相关的研究,至2020年年初,已经有二十余篇文章发表,主要涉及HIV病毒感染不同阶段免疫系统的变化以及ART治疗相关免疫机制等方面。
01
HIV病毒感染过程中对于不同免疫亚群的影响
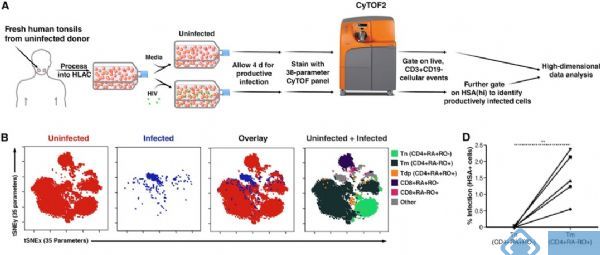
CD4+ T 细胞是HIV 病毒的主要攻击对象,也是该领域内最受关注的细胞种类。2017 年,在Cell Rep.报道的一项研究中,美国 Gladstone 病毒与免疫研究所利用体外实验研究了HIV 感染对于CD4+T 细胞的影响。利用质谱流式,研究人员细致分析了不同感染时间点CD4+T 细胞38 个表面marker 的表达,对T 细胞表型进行了精细的亚群和降维分析。短期融合实验(2h)表明,HIV 对CD4+T 的结合是具有选择性的,它只结合包含记忆CD4+ T 细胞(CD4+ Tm)在内的部分细胞;而长期感染实验(4day)则揭示了宿主细胞与病毒之间复杂的相互作用关系:一方面CD4+T 的表型在此过程中发生了显著的变化(如图1);另一方面,在不同T 细胞亚群中,病毒基因的表达情况也有显著不同。例如CD57+和CD127+Tm 都会感染HIV,但是病毒基因只在前者里面表达,提示在部分CD4+T 细胞中对于HIV 病毒存在“post-entry block”机制[4]。
注意B 图中,由于几个主要marker 的表达发生较大改变,在tsne 图中,相当一部分被感染细胞(蓝色)已经无法和未感染(红色)细胞重合。图片来源:[4]
2018 年 Manganaro 等人在此方向进行了更深入的研究,利用质谱流式HIV 感染的T 细胞进行了19 个通道的同时检测,研究人员发现IL-15 可以促进CD4+ Tm 干细胞的增殖,显著改变CD4+ Tm 的组成,在建立具有自我更新能力的HIV 存储库的过程中发挥关键作用,相关信号通路的抑制剂则保护CD4+Tm 免受病毒的感染。[3]
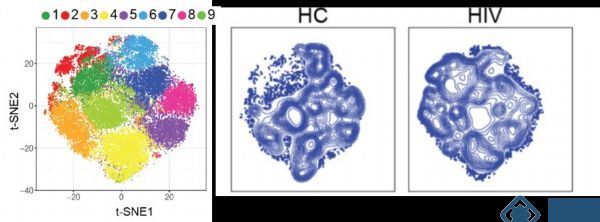
除了CD4+Tm 以外,TFH(滤泡辅助T,follicular helper T)也是该领域一个研究热点。Tfh 表达 CXCR5,这使得它们能够归巢到淋巴结的T 细胞和B 细胞区域之间的界面,它们通过抗原呈递与B 细胞相互作用,在促进B 细胞分化和亲和力成熟中起着不可或缺的作用。因此HIV 对于TFH 活性的影响直接影响患者体液免疫功能的发挥。2018 年Sci Immunol.发表的Wendel BS 等人关于HIV 慢性感染者TFH 的研究。利用质谱流式对病人淋巴结T 细胞进行了37 个marker 的同时检测,通过进行tSNE 和DenVM 分析,作者发现,与健康对照相比,HIV 患者具有更多的CD38+TFH 细胞,具有单一表达IL-21 的激活型表型。(如图2)后续实验结果表明在慢性感染阶段TFH 细胞依然可以对HIV 抗原做出反应,但在持续抗原刺激作用下功能发生倾斜,仅具有非常有限的TCR 克隆谱系[2] ;
左图:全部细胞的亚群组成,中图右图显示健康对照和HIV患者,图片来源文献[2]
此外,质谱流式还可以帮助研究者发现一些疾病相关的新亚群,揭示发病过程一些新的免疫机制。2019年Del Alcalza D等人利用质谱流式检测了HIV感染的淋巴结T细胞上36个marker的表达,系统分析了CD4+T细胞的亚群组成。研究发现,患者淋巴结内存在一群可以分泌IL-21的CXCR5-细胞。后续的细胞功能试验和TCR受体测序结果说明其具有和TFH类似的功能,并具有部分重合的TCR克隆谱系,同时该群细胞对外周血CXCR5-CD4+T cells也有贡献。这些信息串在一起,揭示了一个在HIV慢性感染过程中连接淋巴结病理学和循环T细胞的新机制,拓展了我们对于T调节B细胞功能多样性的认识。[5]。
2)CD8+ T
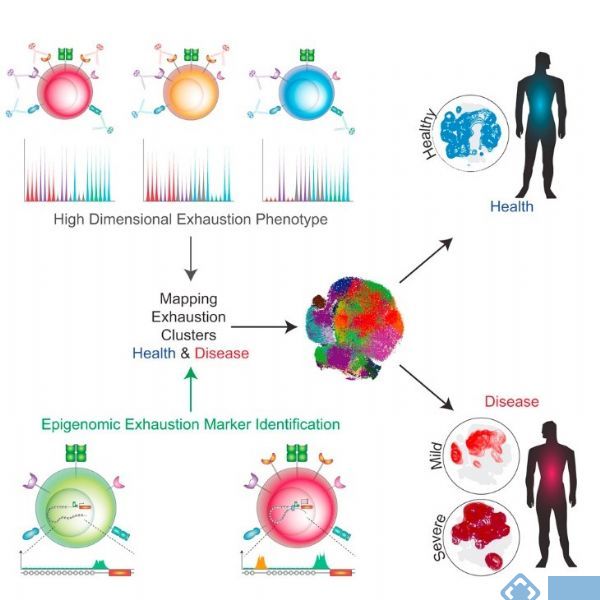
耗竭型CD8+T细胞是HIV进入慢性感染的标志。2018年Bengsch等人利用质谱流式对患者耗竭型CD8+T(Tex)的表型进行了深入研究。基于前期表观遗传的数据,作者筛选了16多个与功能耗竭相关marker加入质谱流式Panel进行分析,从单细胞的水平分析Tex的耗竭表型。经过PhenoGraph聚类,他们得到了在9个表型不同的Tex细胞亚群,定义了不同抑制性受体在各个Tex亚群上的表达组合模式。然后,根据他们的比例信息,制作了表征疾病状态的指标。这对于研究慢性感染,自身免疫和癌症中的免疫监测和免疫调节机制都具有重要意义(如图3)。[1]
(图片来源文献[1])
3)其他免疫细胞
此外,还有多想研究通过质谱流式分别对于HIV感染者DC、NK、PMN,Macrophage等其他免疫亚群的深入的表型和功能分析。他们的研究从不同侧面展示了HIV感染对于人体免疫系统带来的巨大影响,揭示了HIV感染过程中,慢性免疫激活的建立和维持,以及最后导致免疫衰竭的诸多重要分子机制。[9][10][11][15][7]
在ART治疗过程中,伴随病毒水平的降低,免疫细胞各种marker的表达及功能活性也发生了复杂的变化,这些现象对于研究ART治疗的作用机制,探索更有有效的治疗手段至关重要。质谱流式以其多通道的优势,有力了支持了这些方向研究。
2019年 Bekele Y为首的研究小组利用质谱流式分析了在不同感染期接受ART治疗的病人外周血样本,通过对比研究人员发现,急性感染期开始ART治疗的病人比慢性期开始ART治疗的病人具有更丰富的CD27, CD28, CD127, CD44高表达T细胞亚群,这提示前者保留了更好的免疫功能。[6]
小结:
综上,通过单细胞水平的多参数检测,质谱流式可以全面系统的分析分析HIV病毒感染不同阶段以及治疗过程中免疫系统的表型和功能改变,为人类进一步了解和控制该疾病提供了有益的探索。在肿瘤等其他疾病的研究中,科研人员已经通过质谱流式找到了一些用于临床诊断和预后的生物标志物[22,23],相信未来在HIV的研究领域,还将有更多的更加贴近临床的研究和发现。
参考文献
1. Epigenomic-Guided Mass Cytometry Profiling Reveals Disease-Specific Features of Exhausted CD8 T Cells
Bengsch B, Ohtani T, Khan O, Setty M, Manne S, O'Brien S, Gherardini PF, Herati RS, Huang AC, Chang KM, Newell EW, Bovenschen N, Pe'er D, Albelda SM, Wherry EJ.
Immunity. 2018 May 15;48(5):1029-1045.e5. doi: 10.1016/j.immuni.2018.04.026.
2. The receptor repertoire and functional profile of follicular T cells in HIV-infected lymph nodes
Wendel BS, Del Alcazar D, He C, Del Río-Estrada PM, Aiamkitsumrit B, Ablanedo-Terrazas Y, Hernandez SM, Ma KY, Betts MR, Pulido L, Huang J, Gimotty PA, Reyes-Terán G, Jiang N, Su LF.
Sci Immunol. 2018 Apr 6;3(22):eaan8884. doi: 10.1126/sciimmunol.aan8884.
3. IL-15 regulates susceptibility of CD4(+) T cells to HIV infection
Manganaro L, Hong P, Hernandez MM, Argyle D, Mulder LCF, Potla U, Diaz-Griffero F, Lee B, Fernandez-Sesma A, Simon V.
Proc Natl Acad Sci U S A. 2018 Oct 9;115(41):E9659-E9667. doi: 10.1073/pnas.1806695115. Epub 2018 Sep 26.
4. Mass Cytometric Analysis of HIV Entry, Replication, and Remodeling in Tissue CD4+ T Cells
Cavrois M, Banerjee T, Mukherjee G, Raman N, Hussien R, Rodriguez BA, Vasquez J, Spitzer MH, Lazarus NH, Jones JJ, Ochsenbauer C, McCune JM, Butcher EC, Arvin AM, Sen N, Greene WC, Roan NR.
Cell Rep. 2017 Jul 25;20(4):984-998. doi: 10.1016/j.celrep.2017.06.087.
5. Mapping the Lineage Relationship between CXCR5(+) and CXCR5(-) CD4(+) T Cells in HIV-Infected Human Lymph Nodes
Del Alcazar D, Wang Y, He C, Wendel BS, Del Río-Estrada PM, Lin J, Ablanedo-Terrazas Y, Malone MJ, Hernandez SM, Frank I, Naji A, Reyes-Terán G, Jiang N, Su LF.
Cell Rep. 2019 Sep 17;28(12):3047-3060.e7. doi: 10.1016/j.celrep.2019.08.037.
6. Mass cytometry identifies distinct CD4+ T cell clusters distinguishing HIV-1-infected patients according to antiretroviral therapy initiation
Bekele Y, Lakshmikanth T, Chen Y, Mikes J, Nasi A, Petkov S, Hejdeman B, Brodin P, Chiodi F.
JCI Insight. 2019 Feb 7;4(3):e125442. doi: 10.1172/jci.insight.125442. [Epub ahead of print]
7. Upregulation of Chitinase 1 in Alveolar Macrophages of HIV-Infected Smokers
Logue EC, Neff CP, Mack DG, Martin AK, Fiorillo S, Lavelle J, Vandivier RW, Campbell TB, Palmer BE, Fontenot AP.
J Immunol. 2019 Mar 1;202(5):1363-1372. doi: 10.4049/jimmunol.1801105. Epub 2019 Jan 21.
8. Mass Cytometry Analysis Reveals the Landscape and Dynamics of CD32a(+) CD4(+) T Cells From Early HIV Infection to Effective cART
Coindre S, Tchitchek N, Alaoui L, Vaslin B, Bourgeois C, Goujard C, Avettand-Fenoel V, Lecuroux C, Bruhns P, Le Grand R, Beignon AS, Lambotte O, Favier B; ANRS CO6 PRIMO Cohort.
Front Immunol. 2018 Jun 4;9:1217. doi: 10.3389/fimmu.2018.01217. eCollection 2018.
9. Mass Cytometry Analysis Reveals Complex Cell-State Modifications of Blood Myeloid Cells During HIV Infection
Coindre S, Tchitchek N, Alaoui L, Vaslin B, Bourgeois C, Goujard C, Lecuroux C, Bruhns P, Le Grand R, Beignon AS, Lambotte O, Favier B.
Front Immunol. 2019 Nov 22;10:2677. doi: 10.3389/fimmu.2019.02677. eCollection 2019.
10. CD161 Defines a Functionally Distinct Subset of Pro-Inflammatory Natural Killer Cells
Kurioka A, Cosgrove C, Simoni Y, van Wilgenburg B, Geremia A, Bj
Front Immunol. 2018 Apr 9;9:486. doi: 10.3389/fimmu.2018.00486. eCollection 2018.
11. Characterization of Leukocytes From HIV-ART Patients Using Combined Cytometric Profiles of 72 Cell Markers
Leite Pereira A, Tchitchek N, Lambotte O, Le Grand R, Cosma A.
Front Immunol. 2019 Aug 6;10:1777. doi: 10.3389/fimmu.2019.01777. eCollection 2019.
12. TIGIT is upregulated by HIV-1 infection and marks a highly functional adaptive and mature subset of natural killer cells
Vendrame E, Seiler C, Ranganath T, Zhao NQ, Vergara R, Alary M, Labbé AC, Guédou F, Poudrier J, Holmes S, Roger M, Blish CA.
AIDS. 2020 Feb 5. doi: 10.1097/QAD.0000000000002488. doi: 10.1097/QAD.0000000000002488. [Epub ahead of print]
13. Identification of NK Cell Subpopulations That Differentiate HIV-Infected Subject Cohorts with Diverse Levels of Virus Control
Pohlmeyer CW, Gonzalez VD, Irrinki A, Ramirez RN, Li L, Mulato A, Murry JP, Arvey A, Hoh R, Deeks SG, Kukolj G, Cihlar T, Pflanz S, Nolan GP, Min-Oo G.
J Virol. 2019 Mar 21;93(7):e01790-18. doi: 10.1128/JVI.01790-18. Print 2019 Apr 1.
14. New assays for monitoring residual HIV burden in effectively treated individuals
Strain MC, Richman DD.
Curr Opin HIV AIDS. 2013 Mar;8(2):106-10. doi: 10.1097/COH.0b013e32835d811b.
15. Mass Cytometry Reveals the Immaturity of Circulating Neutrophils during SIV Infection
Lemaitre J, Cosma A, Desjardins D, Lambotte O, Le Grand R.
J Innate Immun. 2019 Jun 21:1-12. doi: 10.1159/000499841. [Epub ahead of print]
16. Standardization and quality control for high-dimensional mass cytometry studies of human samples
Kleinsteuber K, Corleis B, Rashidi N, Nchinda N, Lisanti A, Cho JL, Medoff BD, Kwon D, Walker BD.
Cytometry A. 2016 Oct;89(10):903-913. doi: 10.1002/cyto.a.22935. Epub 2016 Aug 30.
17. A high-resolution mass cytometry analysis reveals a delay of cytokines production after TLR4 or TLR7/8 engagements in HIV-1 infected humans
Leite Pereira A, Tchitchek N, Marcos Lopez E, Lambotte O, Le Grand R, Cosma A.
Cytokine. 2018 Nov;111:97-105. doi: 10.1016/j.cyto.2018.08.018. Epub 2018 Aug 20.
18. Comprehensive mass cytometry analysis of cell cycle, activation, and coinhibitory receptors expression in CD4 T cells from healthy and HIV-infected individuals. Corneau, A. et al. Cytometry B Clinical Cytometry 92 (2017): 21–32.
19. Comprehensive Mass Cytometry Analysis of Cell Cycle, Activation, and Coinhibitory Receptors Expression in CD4 T Cells from Healthy and HIV-Infected Individuals
Corneau A, Cosma A, Even S, Katlama C, Le Grand R, Frachet V, Blanc C, Autran B.
Cytometry B Clin Cytom. 2017 Jan;92(1):21-32. doi: 10.1002/cyto.b.21502.
20. VOLARE: visual analysis of disease-associated microbiome-immune system interplay
Siebert JC, Neff CP, Schneider JM, Regner EH, Ohri N, Kuhn KA, Palmer BE, Lozupone CA, G C.BMC Bioinformatics. 2019 Aug 20;20(1):432. doi: 10.1186/s12859-019-3021-0.
21. An Optimized and Validated Method for Isolation and Characterization of Lymphocytes from HIV+ Human Gut Biopsies
Trapecar M, Khan S, Roan NR, Chen TH, Telwatte S, Deswal M, Pao M, Somsouk M, Deeks SG, Hunt PW, Yukl S, Sanjabi S.
AIDS Res Hum Retroviruses. 2017 Nov;33(S1):S31-S39. doi: 10.1089/AID.2017.0208.
22. An immune atlas of clear cell renal cell carcinoma. Chevrier, S. et al.
Cell 169 (2017): 736–749.
23 High-dimensional single-cell analysis predicts response to anti-PD-1 immunotherapy.
Krieg, C. et al. Nature Medicine 24 (2018): 144–153.
相关阅读: