Cell:单细胞测序揭示结肠癌的免疫治疗新机制
免疫检查点阻断(ICB)能够破坏癌细胞对免疫系统的监视,并显著改变癌症的治疗模式。抗肿瘤免疫的常用治疗策略包括消除肿瘤微环境(TME)中的致癌细胞或免疫抑制细胞,通过使用激动性抗体激活特定免疫群体。然而,对TME复杂性的不完全理解及明确理论基础的缺乏,导致许多策略“不分青红皂白地”被推进到临床。
单细胞RNA测序(scRNA-seq)是一种分析实体瘤复杂性的强大技术,能够前所未有地细节描述细胞多样性和异质表型状态。原发性人类肿瘤中基于scRNA-seq的转录组分析不仅揭示了T细胞的异质性,而且已开始通过整合转录组和T细胞受体的分析来阐明T细胞种群之间的动态关系。
今年4月16号,北大生科院张泽明教授团队发表在《Cell》上的一篇文章通过分析人和小鼠的scRNA序列数据,揭示了这些细胞的异质性和功能,从临床前模型为人类癌症的髓样细胞调节疗法提供理论基础。
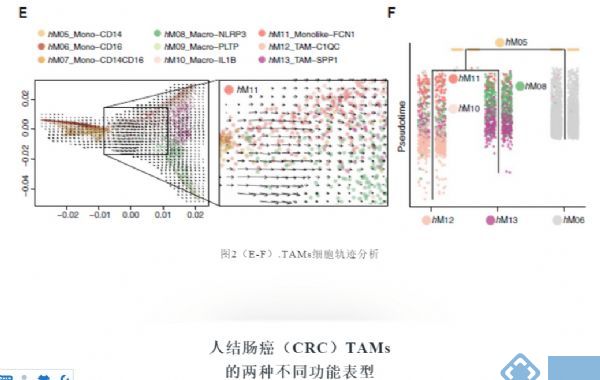
通过分析RNA速率嵌入扩散图推断细胞未来命运,确定了从表达CD14的单核细胞向FCN1+ 单核细胞和不同巨噬细胞群的定向流动(图2E)。
通过两种正交算法URD和PAGA进一步破译巨噬细胞的转录轨迹,结果显示FCN1+单核细胞可通过不同的RTM演变成C1QC+和SPP1+TAM群(图2F)。总之,这些数据表明C1QC+和SPP1+TAMs都是由肿瘤浸润的单核细胞前体发展而来。
通过分析RNA速率嵌入扩散图推断细胞未来命运,确定了从表达CD14的单核细胞向FCN1+ 单核细胞和不同巨噬细胞群的定向流动(图2E)。
通过两种正交算法URD和PAGA进一步破译巨噬细胞的转录轨迹,结果显示FCN1+单核细胞可通过不同的RTM演变成C1QC+和SPP1+TAM群(图2F)。总之,这些数据表明C1QC+和SPP1+TAMs都是由肿瘤浸润的单核细胞前体发展而来。
通过分析RNA速率嵌入扩散图推断细胞未来命运,确定了从表达CD14的单核细胞向FCN1+ 单核细胞和不同巨噬细胞群的定向流动(图2E)。
通过两种正交算法URD和PAGA进一步破译巨噬细胞的转录轨迹,结果显示FCN1+单核细胞可通过不同的RTM演变成C1QC+和SPP1+TAM群(图2F)。总之,这些数据表明C1QC+和SPP1+TAMs都是由肿瘤浸润的单核细胞前体发展而来。
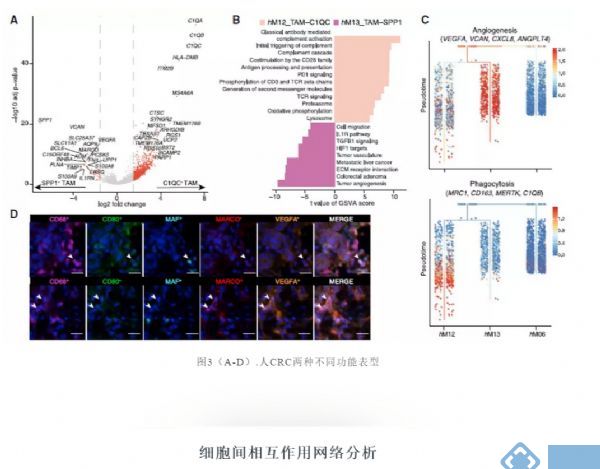
进一步分析TAM群体间差异表达的基因,发现C1QC+ TAMs表现出补体C1Q基因、TREM2、MERTK和CD80的高表达,而SPP1+ TAMs显示SPP1、MARCO和VEGFA的特异性表达(图3A)。
利用基因集变异分析(GSVA)评估两个TAM群体中已知的信号通路,发现SPP1+ TAMs在肿瘤血管生成、细胞外基质受体相互作用和肿瘤血管通路的富集,而C1QC+ TAMs中补体激活、抗原呈递等通路被显著激活(图3B)。
值得注意的是,SPP1+ TAMs还表现出大肠腺瘤和转移性肝癌途径的特异性富集(图3B和3C),提示在大肠癌中具有促肿瘤转移的作用。多色成像数据也通过分别表达CD68、CD80、MAF和CD68、MARCO和VEGFA证实了TAMs这两个子集的存在(图3D)。
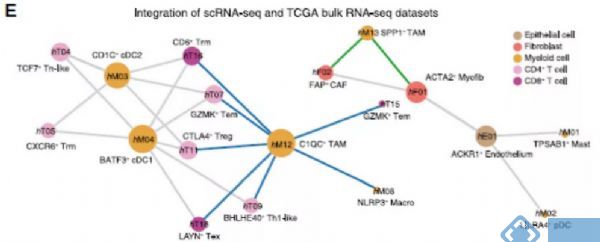
在人CRC中发现了细胞间明显的相互作用,TAMs和cDCs作为预测网络的核心,与其他细胞类型的连接最多(图3E)。SPP1+ TAMs与CAFs和肌成纤维细胞相互作用,而C1QC+ TAMs和两组cDCs主要与其他免疫细胞,特别是T细胞亚群相互作用(图3E)。
在与髓样细胞和T细胞相关的配体受体对中,CXCL10-CXCR3在C1QC+ TAMs中显著富集(图3F),暗示C1QC+ TAMs在招募或激活T细胞中的潜在作用。与C1QC+ TAMs和其他白细胞相比,SPP1+ TAMs显示SDC2的优先表达,SDC2与MMP2结合,MMP2是CAFs和内皮细胞高度表达的基因(图3F),据报道与多种癌症类型的肿瘤生长和转移有关。
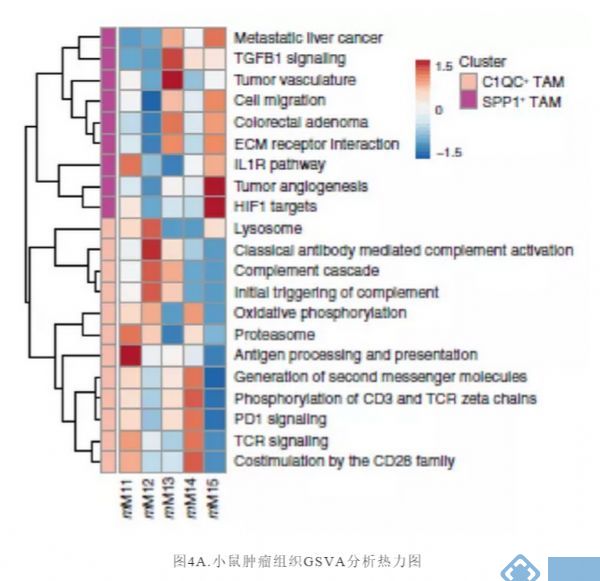
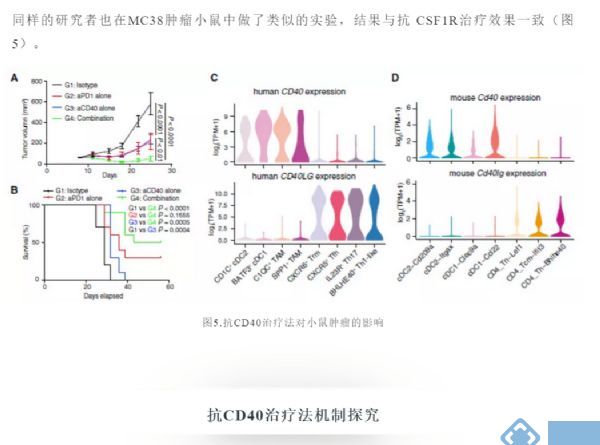
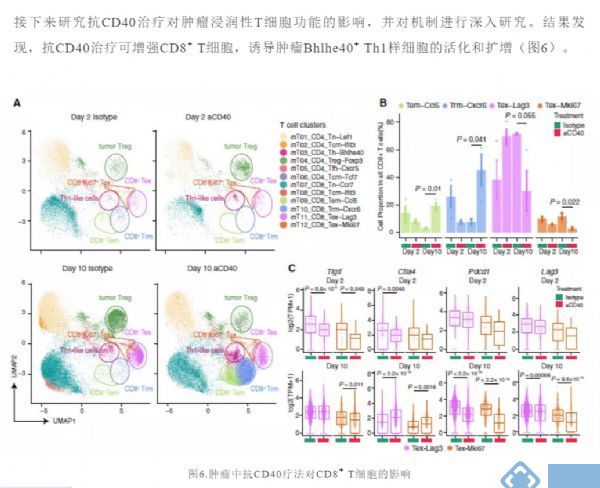
下一步,研究者试图用scRNA-seq研究不同髓细胞群对小鼠肿瘤模型抗肿瘤免疫反应的影响,并将这些数据与我们对人类髓细胞异质性的发现联系起来。对小鼠TAM亚群进行类似于人类TAM簇的信号通路分析(图3B),发现小鼠TAM亚群也与其血管生成、缺氧和T细胞相互作用有关(图4A)。
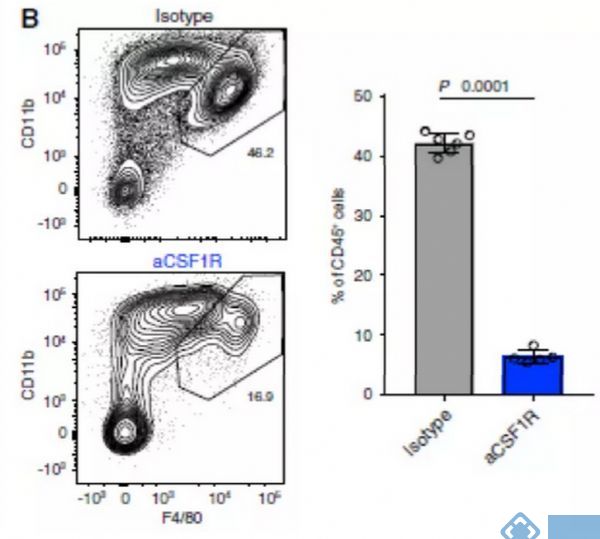
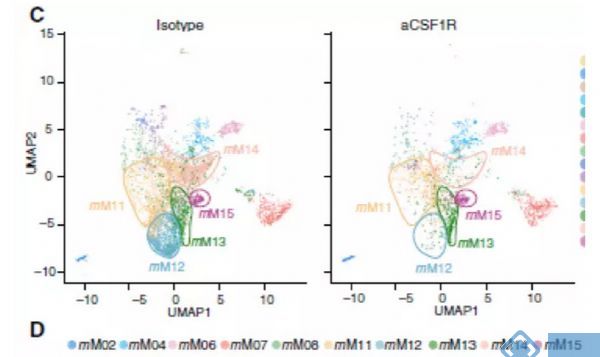
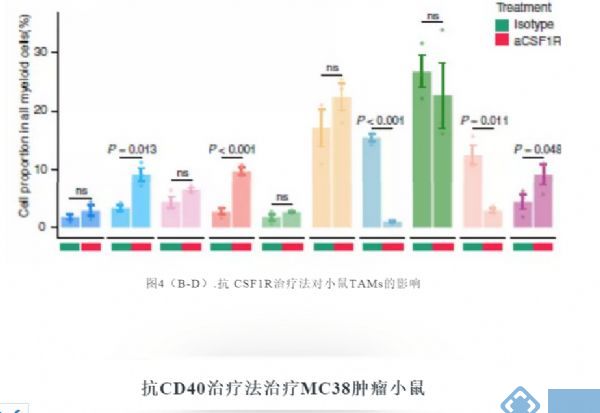
研究关注两种在临床试验中被广泛应用的治疗策略:CSF1R阻断法使TAM耗竭和CD40激动剂激活DC。接下来试图阐明抗CSF1R对小鼠TAM亚群的作用,并将这些发现与人类相应的细胞群体相联系。正如预期,用抗CSF1R治疗患有Renca肿瘤的小鼠,与用对照抗体治疗相比,TAMs的数目减少(图4B)。用抗CSF1R治疗后,mM12和mM14簇几乎完全丧失,但mM11、mM13和mM15的减少最小(图4C和4D)。