恐惧记忆是生物体适应复杂生存环境的保护性机制之一。然而,过度的、不合理的恐惧记忆对机体却是极其有害的,是导致抑郁症、焦虑症、创伤后应激障碍等重大情感和精神障碍的首要因素。作为生物体进化出的灵活应对恐惧记忆的重要机制,消退训练(Extinction)是通过形成新的消退记忆用以对抗固有恐惧记忆的认知过程。消退记忆是机体通过调整学习行为以适应复杂环境变化的生理基础,具有极为重要的理论和现实意义。现有的恐惧记忆消退策略是从认知层面减低恐惧情绪,是当前相关神经精神疾病治疗的主要治疗手段,然而这种方法并不能完全消除恐惧记忆:新形成的消退记忆容易遗忘或丢失,导致固有的恐惧记忆再次出现(记忆重现, Renewal)或自发恢复(Spontaneous recovery)。
恐惧记忆重现会进一步滋生绝望情绪甚至引起重度抑郁乃至**。因此,恐惧记忆消退-重现转换的神经环路和分子机制,是脑认知和脑疾病研究前沿的重大“痛点”问题。针对这一问题,2021年徐天乐团队发表于National Science Review杂志的论文揭示了恐惧记忆消退-重现转换的场景依赖性以及感觉输入联合性的突触整合规律,为制定针对抑郁症、焦虑症等神经精神疾病的新型干预策略提供了科学依据。另一方面,解析恐惧消退形成新记忆的大脑物质基础,刻画消退记忆存储和动态表达的基本规律,亦可以为相关神经精神疾病治疗提供有效手段。
2022年7月8日,复旦大学脑科学转化研究院李伟广研究员、上海交通大学基础医学院徐天乐教授团队和国家儿童医学中心(上海)、上海交通大学医学院附属上海儿童医学中心江帆教授团队合作在Molecular Psychiatry杂志上发表“Dynamic tripartite construct of interregional engram circuits underlies forgetting of extinction memory”的研究论文。研究针对恐惧记忆消退过程中新形成的消退记忆,发现了以内侧前额叶皮层(medial prefrontal cortex, mPFC)为中心的消退记忆印迹神经网络,揭示了消退记忆印迹网络的工作模型,以及跨脑区消退记忆印迹神经连接的动态变化规律,为理解抑郁症、创伤后应激障碍等神经精神疾病治疗后复发提供了科学依据。

结果
01 消退记忆印迹神经元的分布
首先,作者运用声音-电击偶联恐惧记忆行为学范式结合基于神经活性细胞群靶向重组技术的记印迹细胞标记方法(FosTRAP策略)探究消退记忆的印迹细胞基础。将FosTRAP2 x H2B-GFP双转基因小鼠给予1天的声音-电击偶联恐惧学习训练(Conditioning A),随后小鼠接受3天的消退记忆训练(Extinction B),并在第3天消退训练前30 min给予小鼠4-羟基他莫西昔芬(4-OHT)处理,促使在记忆消退过程中激活的神经元表达H2B-GFP(图1a),结果发现消退记忆印迹细胞存储在内侧前额叶皮层(medial prefrontal cortex, mPFC)、基底外侧杏仁核(basolateral amygdala, BLA)和腹侧海马(ventral hippocampus, vHPC)、丘脑等多个脑区(图1b,c)。
上述双转基因小鼠接受“恐惧记忆消退测试”(ABB测试)或“恐惧记忆重现测试”(ABA测试)(图1d),行为学结果显示,恐惧重现测试引起小鼠更强的恐惧反应(图1e)且c-fos染色结果显示恐惧记忆重现时伴随着消退记忆印迹神经元的抑制。而记忆消退时伴随着这类神经元的再激活(图1f-h)。
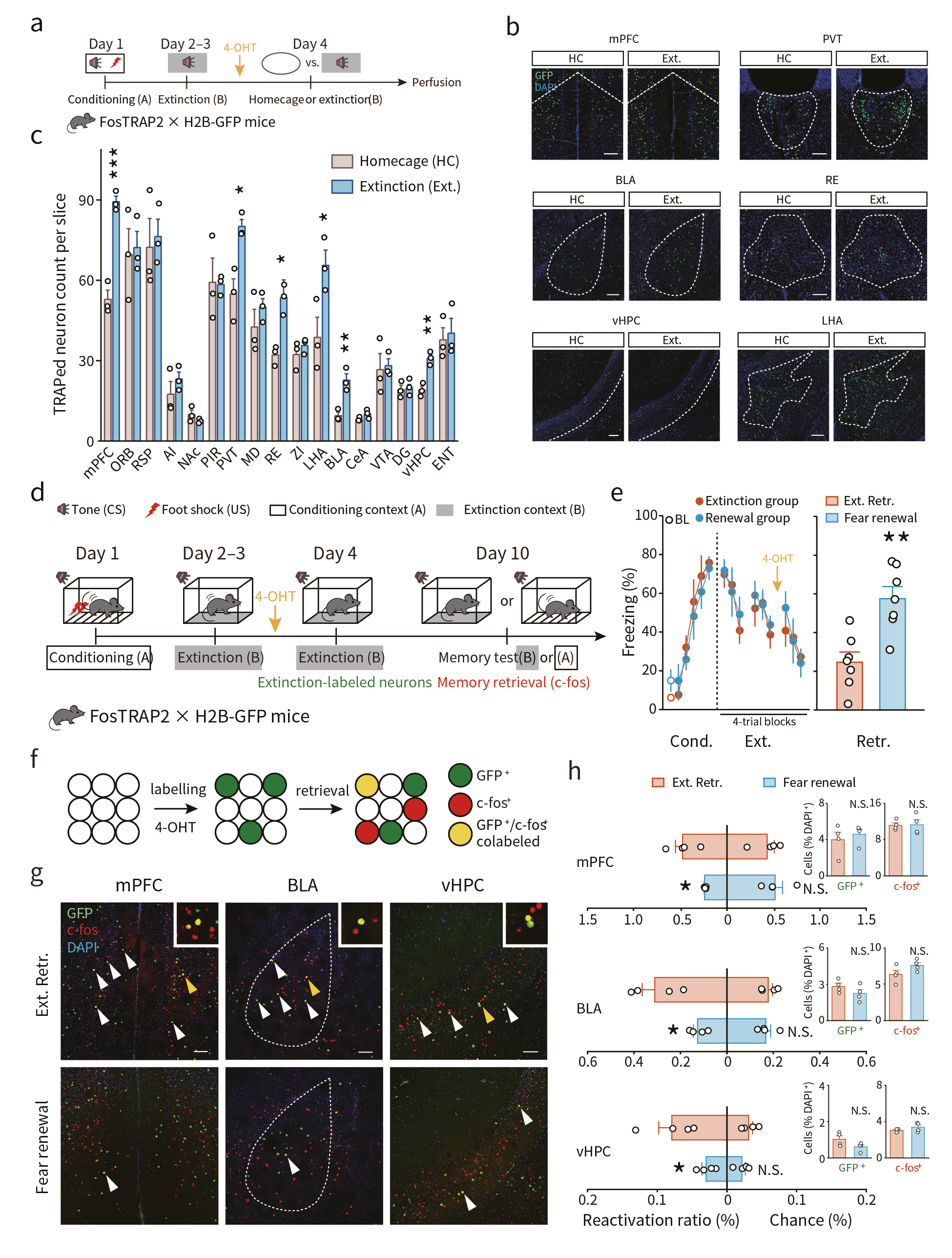
图1 消退记忆印迹神经元的分布
02 消退记忆印迹细胞的双向操纵控制消退记忆的提取
为研究消退记忆印迹细胞群在恐惧记忆相关行为中的调控作用,研究者在TRAP2(Fos2A-iCreER)小鼠mPFC中注射AAV-EF1α-DIO-NpHR3.0-EGFP病毒,并埋入光纤,随后小鼠接受恐惧记忆行为学范式(图2a)。结果显示,在消退记忆测试阶段,借助光遗传学技术抑制消退记忆印迹细胞群,可引起小鼠更强烈的恐惧反应,表现为小鼠的木僵行为(freezing)增加(图2b)。
随后,研究者将AAV-EF1α-DIO-ChR2(E123T/T159C)-mCherry病毒注射于TRAP2小鼠mPFC中,并埋入光纤(图2a)。发现光遗传激活消退记忆印迹细胞群,可导致在恐惧记忆重现测试中小鼠的木僵行为明显下降(图2c),提示了激活这类印迹细胞群可促进恐惧记忆消退,抑制记忆重现。
同样地,光遗传学分别失活或激活BLA和vHPC中相关的记忆印迹细胞可抑制或促进恐惧记忆的消退(图2d-g)。这些结果提示了,记忆消退印迹细胞对于消退记忆提取的充分必要性。
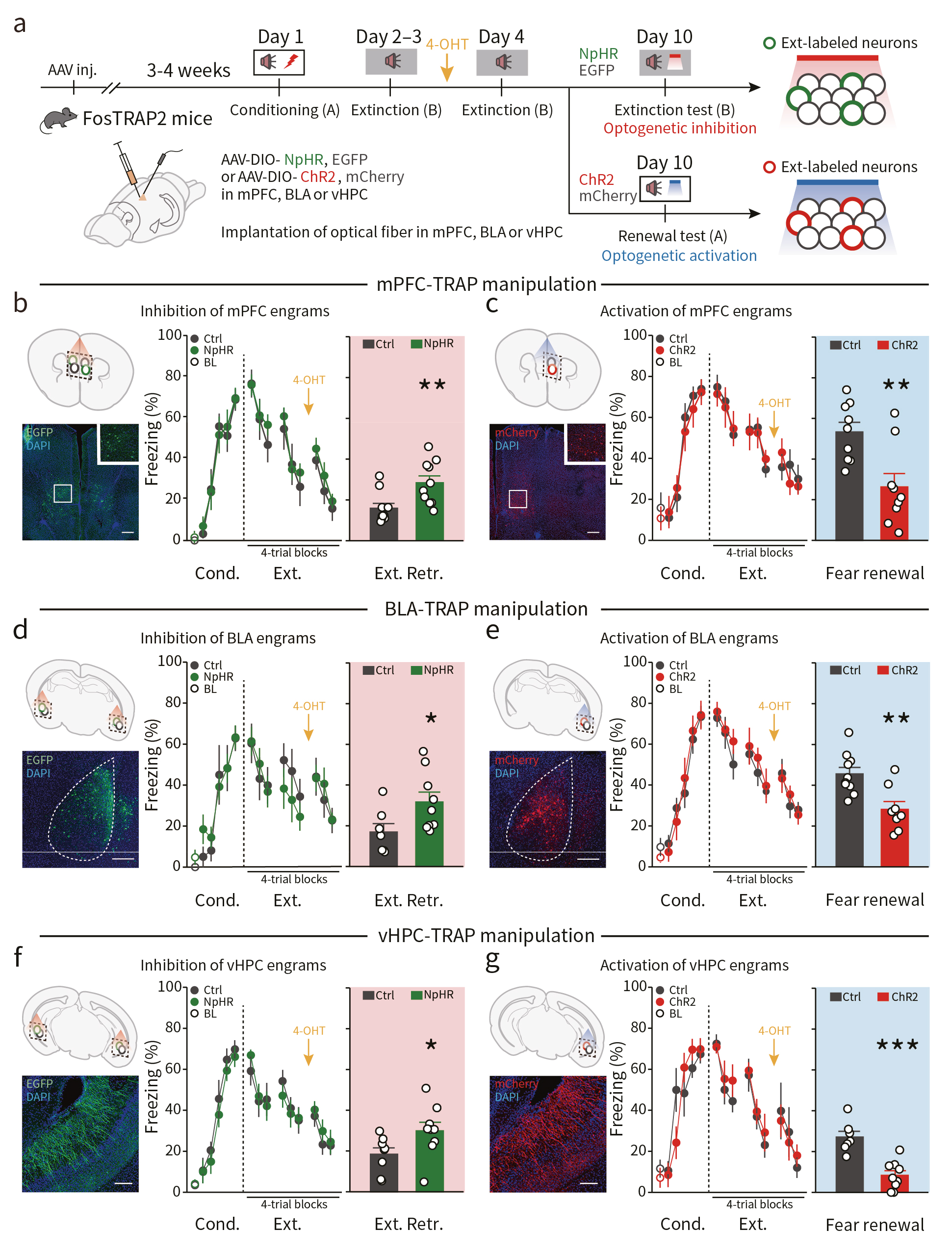
图2 消退印迹细胞的双向操纵控制消退记忆的提取
03 BLA→mPFC和vHPC→mPFC印迹环路介导消退记忆的提取
接下来,作者借助光遗传学技术分别抑制或激活FosTRAP2 x H2B-GFP双转基因小鼠BLA和vHPC中消退记忆印迹细胞,恐惧记忆条件行为学范式结果发现,BLA和vHPC印迹细胞与mPFC印迹细胞之间存在定向的功能连接(图3)。借助病毒示踪技术发现,mPFC印迹神经元接受来自于BLA印迹神经元(BLA→mPFC)和vHPC印迹神经元(vHPC→mPFC)的单突触输入(图4a,b)。
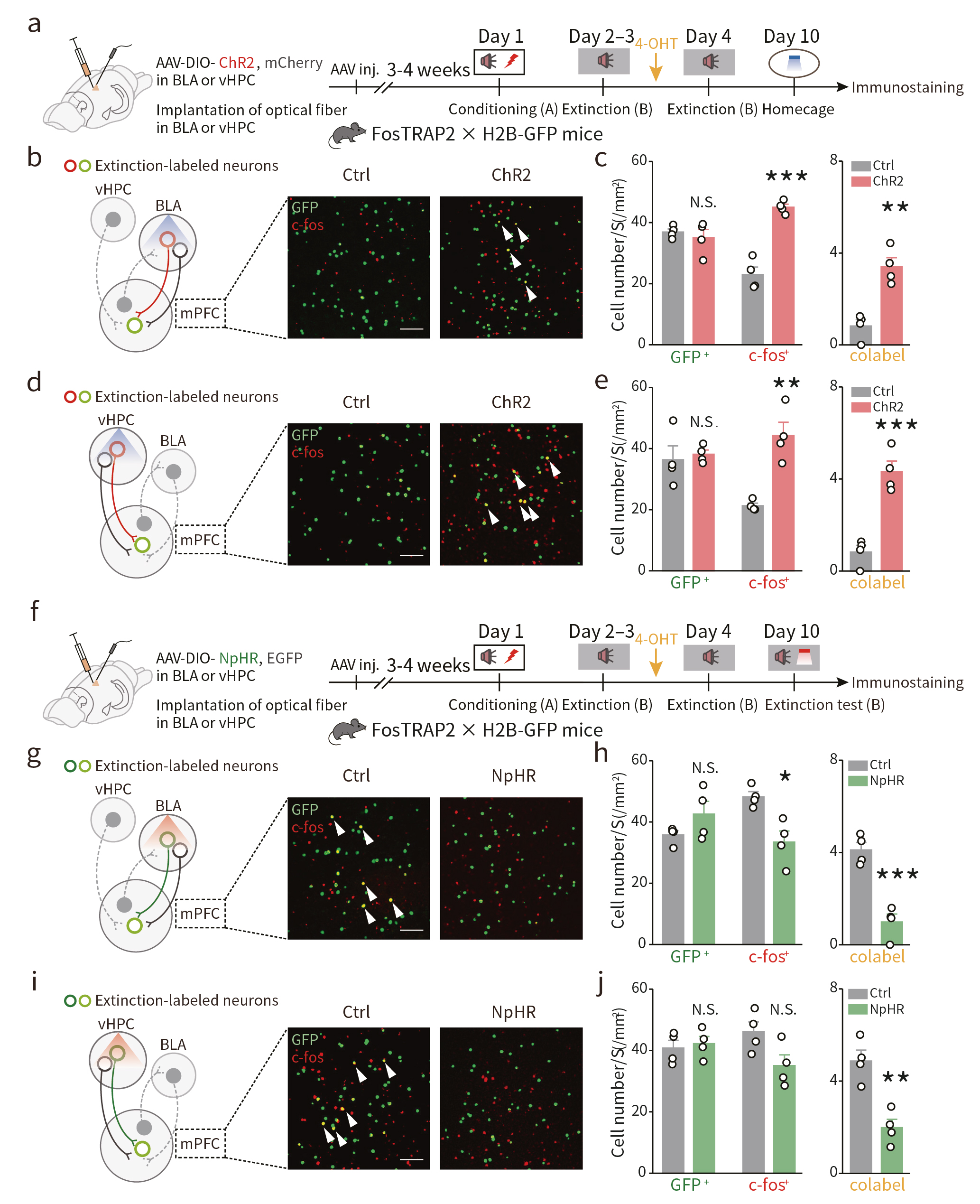
图3 BLA和vHPC印迹细胞与mPFC印迹细胞之间存在定向的功能连接
为直接验证BLA、vHPC和mPFC记忆印迹细胞之间的定向突触联系,研究者在TRAP2小鼠mPFC注射AAV-EF1α-DIO-TetTox-EGFP病毒,BLA或vHPC注射AAV-DIO-ChR2-mCherry病毒(图4c)。发现破伤风毒素轻链TetTox失活mPFC印迹神经元,光遗传激活BLA或vHPC印迹细胞无法逆转恐惧重现(图4d,f);在相反的方向上,阻断BLA或vHPC的突触传递,同时激活mPFC印迹神经元则可以逆转恐惧重现,促进消退记忆表达(图4e,g)。这些结果提示了mPFC作为消退记忆印迹网络的中枢,通过自下而上的传输模式整合来自BLA和vHPC的印迹特异性输入,进而调控消退记忆。

图4 消退记忆提取依赖于BLA→mPFC和vHPC→mPFC印迹环路
04 不同脑区印迹神经元间突触连接的动态重塑调控了消退记忆的提取
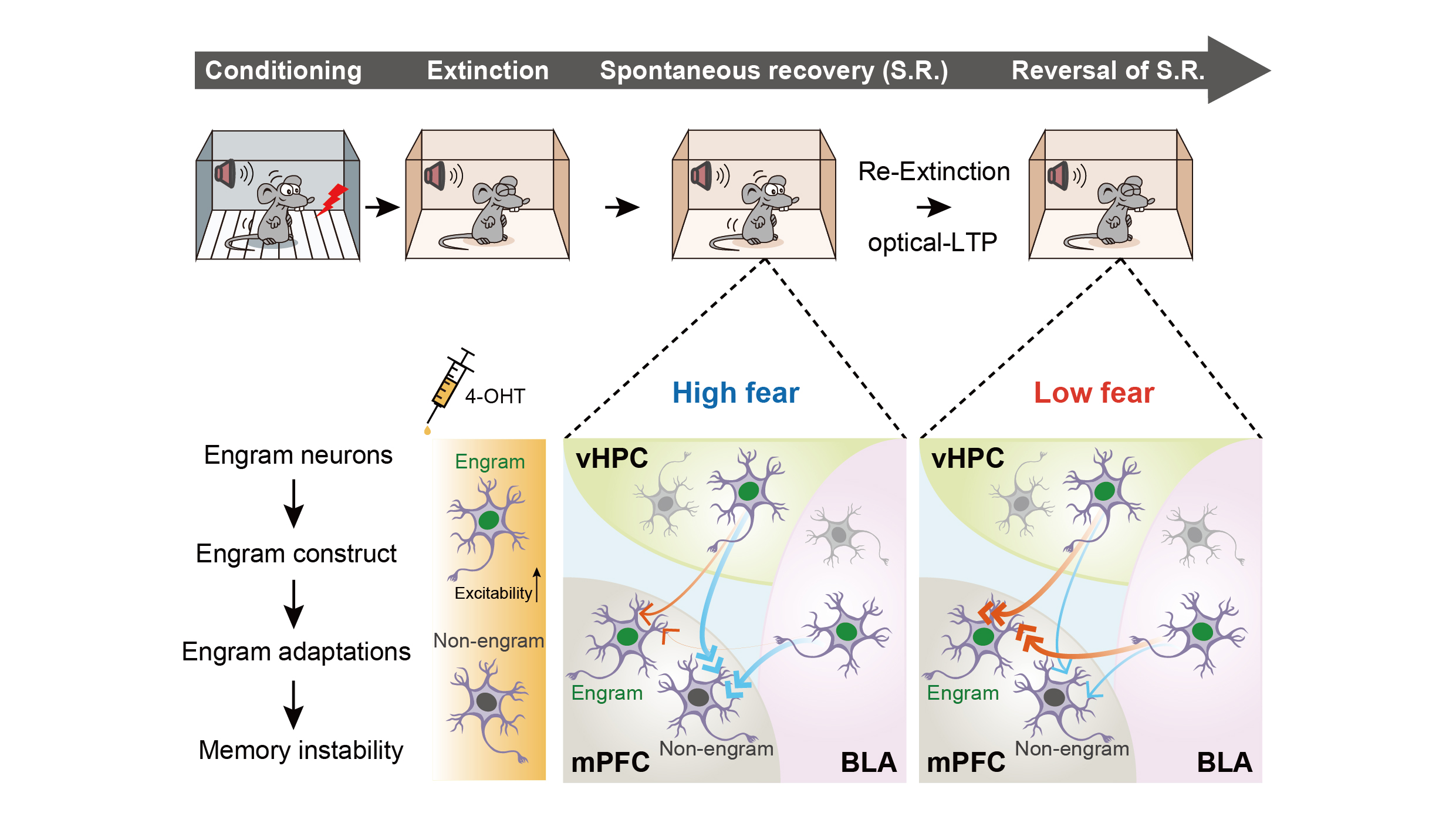
记忆印迹突触的稳定性是记忆强度维持的物质基础。然而,消退记忆并不稳定,其对恐惧记忆的抑制作用会随着时间的推移慢慢减弱,即固有恐惧记忆的复发,称为自发恢复(spontaneous recovery)。这可能是由于消退记忆印迹细胞激活不足导致的。基于此,研究人员借助光遗传结合电生理策略检测了消退训练一个月后,BLA→mPFC印迹细胞和vHPC→mPFC印迹细胞在自发恢复时的突触连接变化(图5a-c)。结果显示,与非印迹神经元相比,BLA→mPFC和vHPC→mPFC印迹神经元在自发恢复时配对脉冲比值(paired-pulse ratios, PPRs)明显升高,提示了印迹神经元突触前递质释放能力减弱,同时,经过再次的消退训练后,BLA→mPFC和vHPC→mPFC印迹神经元突触强度得以重建(图5d,e)。通过比较AMPAR/NMDAR比值,观察到了类似的变化,提示了自发恢复与消退记忆印迹神经元突触后适应性丢失有关(图5f,g)。此外,在相反的方向上(mPFC→BLA),无上述突触变化(图5h-j)。这些结果提示了,恐惧记忆自发恢复可能是由于特定方向的消退记忆印迹神经元突触连接强度减弱导致的。
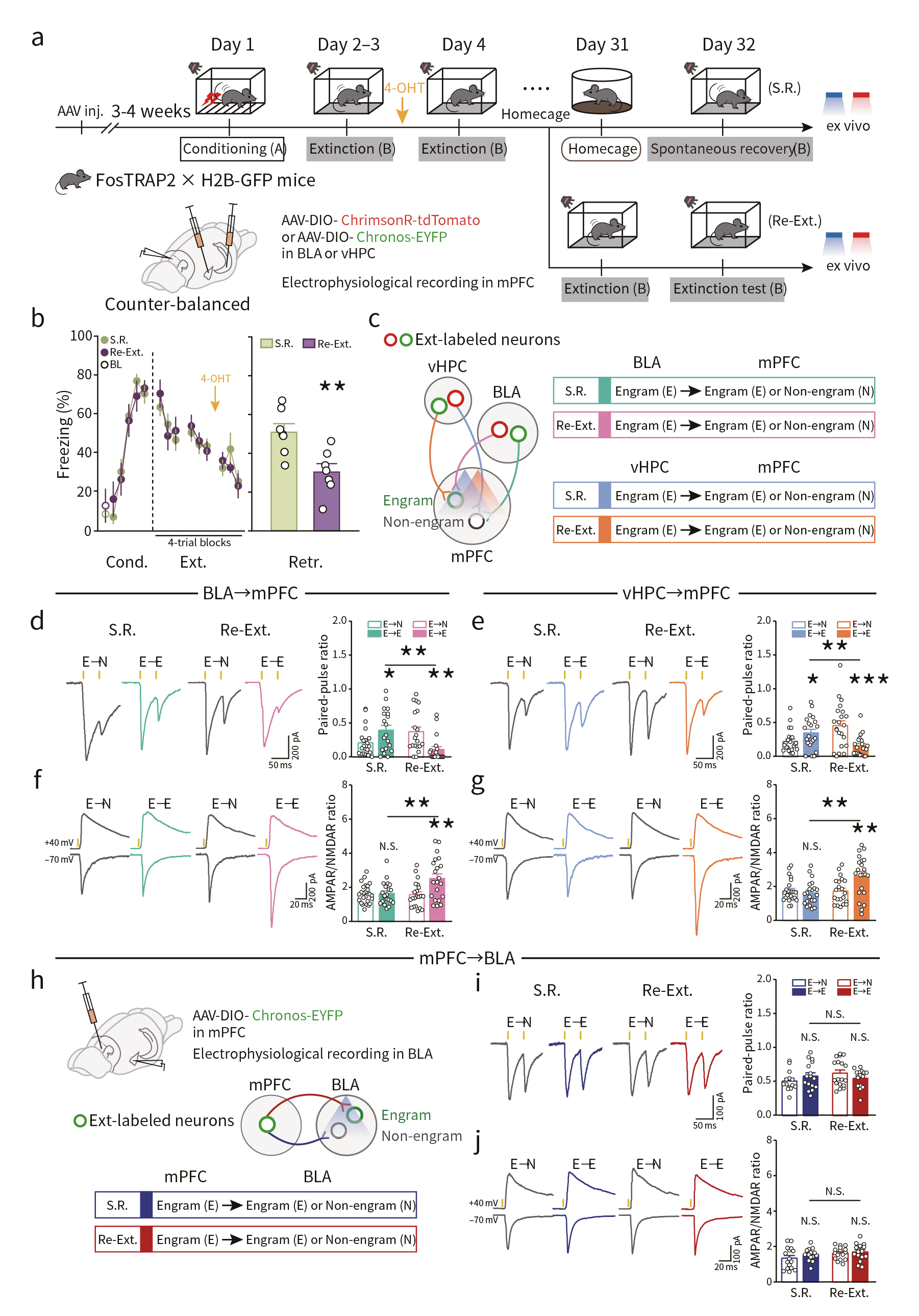
图5 消退记忆印迹连接的动态重塑
最后,研究者验证印迹神经元突触的可逆性。借助AAV病毒载体在FosTRAP2 x H2B-GFP双转基因小鼠的BLA和vHPC印迹神经元中表达ChR2,在mPFC中埋入光纤。结果显示,借助光遗传高频刺激诱发LTP可抑制恐惧记忆的自发恢复,这与自发恢复前再次消退训练的强度相当(图6a,b)。此外,研究者借助在体光纤记录发现,光诱导LTP后光刺激上游BLA和vHPC印迹神经元可导致下游mPFC印迹神经元活性显著增加(图6c-g)。这些结果提示了,BLA→mPFC和vHPC→mPFC印迹神经元之间的突触连接介导了消退记忆提取。
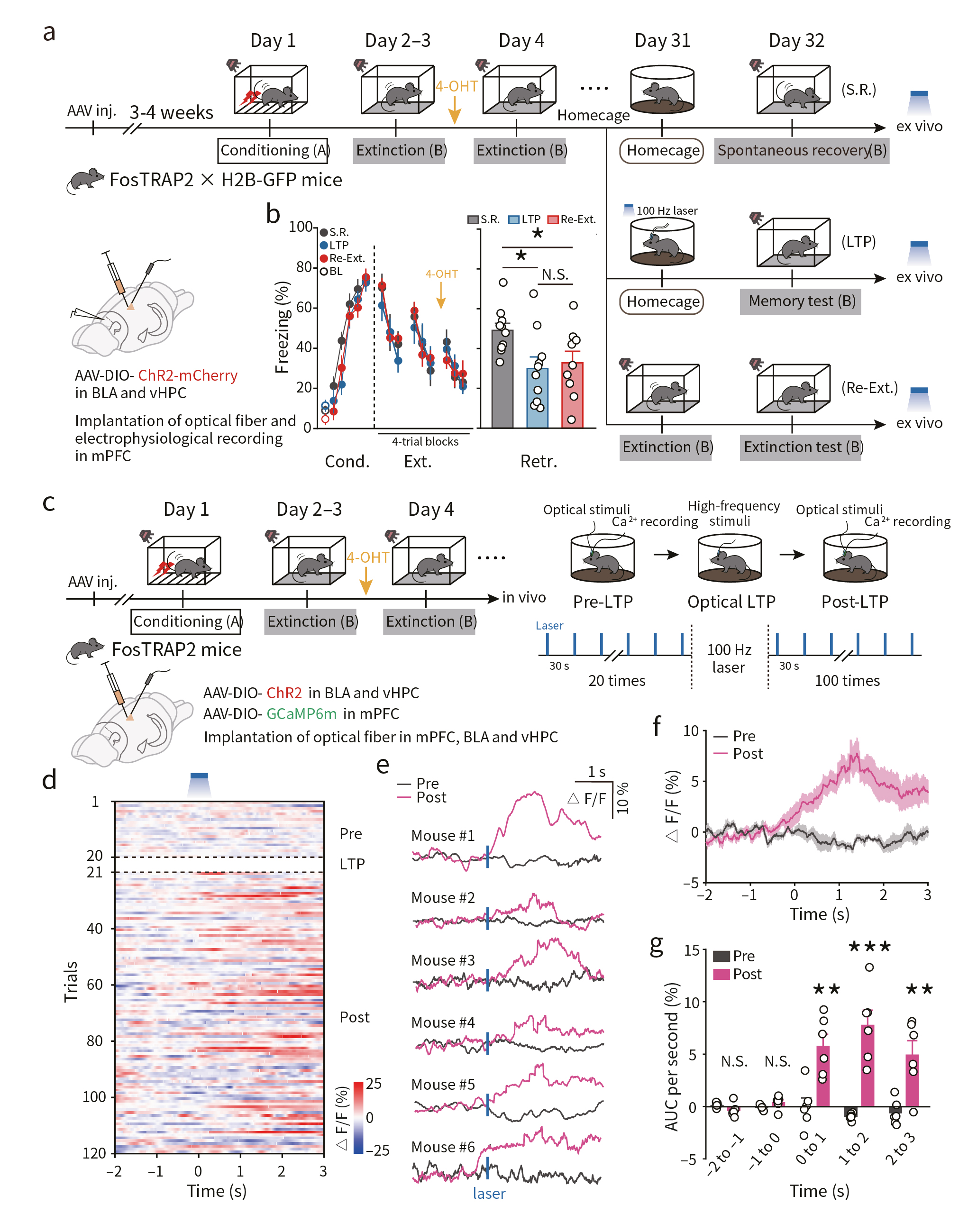
图6 光控LTP增强印迹连接促进消退记忆的提取
结论
本文借助病毒载体示踪技术、TRAP记忆印迹细胞标记技术、行为学、光遗传学、电生理、在体光纤记录等多种技术手段,系统研究了恐惧消退中形成的新记忆—消退记忆,在记忆印迹细胞群及其互相连接构成的印迹环路和印迹网络层面,揭示了消退记忆印迹神经元的工作模式,解析了跨脑区印迹神经连接强度的动态变化规律,为加深理解消退记忆容易遗忘或失效的行为学特征提供了最直接的神经生物学证据。同时也为情感障碍性脑疾病尤其是难治性(易复发)抑郁症和焦虑症等疾病的治疗提供全新思路。
上海交通大学基础医学院博士研究生谷雪和博士后吴延娇为该论文的共同第一作者。复旦大学李伟广研究员、上海交通大学基础医学院徐天乐教授和上海交通大学医学院附属上海儿童医学中心江帆教授为该论文的共同通讯作者。
该研究得到了科技创新2030 —“脑科学与类脑研究”重大项目、国家自然科学基金、上海市级科技重大专项、上海市科委重点项目、上海市教委创新团队、上海交通大学基础医学院基础医学前沿研究中心原创探索类青年支持项目等项目的支持。该研究还得到了加拿大多伦多大学王路阳院士、美国德克萨斯大学休斯顿健康科学中心朱曦教授、上海交通大学基础医学院徐楠杰研究员等的合作支持。
和元生物有幸为研究者提供实验中使用的AAV病毒载体,助力神经科学研究!
